Adv. Sci.|南医大倪春辉团队破局肺纤维化:锁定脂肪酸氧化与糖酵解 “失衡点”,挖掘关键治疗靶点

英文标题:Fatty Acid Oxidation-Glycolysis Metabolic Transition Affects ECM Homeostasis in Silica-Induced Pulmonary Fibrosis
中文标题:脂肪酸氧化-糖酵解代谢转换影响二氧化硅诱导的肺纤维化中细胞外基质稳态
发表期刊:Advanced Science
影响因子:14.3
客户单位:南京医科大学
百趣提供服务:新一代代谢组学NGM 2
1研究背景
肺纤维化是慢性致命性疾病,长期接触二氧化硅粉尘可引发硅肺,是常见且严重的职业病,给个人和社会带来沉重负担。纤维化以成肌纤维细胞异常增殖和细胞外基质(Exracellular Matrix, ECM)过度产生为特征。代谢重编程在肺纤维化中起重要作用,糖酵解和脂肪酸氧化(Fatty Acid Oxidation, FAO)代谢紊乱可能影响ECM的平衡,但具体机制不明。本研究旨在探究其机制,并评估针对调控相关代谢途径和缺氧诱导因子-1α(HIF-1α)的治疗潜力。
2研究结果
1、小鼠肺纤维化的发生伴随着细胞代谢的重构
为分析二氧化硅刺激后的细胞代谢状态,构建经气管内单次滴注二氧化硅悬液的小鼠模型,于暴露后7天、14天、28天收集肺组织。H&E染色结果(图1A)显示,随硅肺进展,肺部炎症和纤维化程度逐渐加重。羟脯氨酸测定表明,肺组织胶原水平随二氧化硅暴露时间延长显著升高(图1B)。在硅肺进展过程中,细胞外基质成分(如纤维连接蛋白、胶原蛋白 I、弹性蛋白)的蛋白质水平通过Western blot检测呈时间依赖性增加(图1C)。为进一步明确胶原沉积形式,对肺组织病理切片进行Masson染色、天狼星红染色及偏振光成像,结果显示纤维化肺组织中胶原纤维大量沉积,结构紊乱且以不溶性胶原为主(图1D)。
为深入探究代谢重构机制,进一步开展转录组和代谢组分析。代谢组学分析(图1E)显示,肺纤维化小鼠肺组织中糖酵解中间产物(如3-磷酸甘油酸、葡萄糖-6-磷酸、磷酸烯醇丙酮酸)含量显著增加,而FAO相关代谢物(如3-羟基丁酸、L-肉碱、硬脂酰肉碱)水平降低,提示糖酵解增强、FAO 减弱的代谢表型。Western blot检测(图1F)进一步证实,糖酵解关键蛋白(HIF-1α、己糖激酶2(HK2)、葡萄糖转运蛋白3(GLUT3)、磷酸果糖激酶2(PFK2))表达上调,而FAO调控蛋白(肉碱棕榈酰转移酶1a(CPT1a)、过氧化物酶体增殖物激活受体γ(PPAR-γ)、PPAR-α水平显著下降,与转录组和代谢组结果一致。
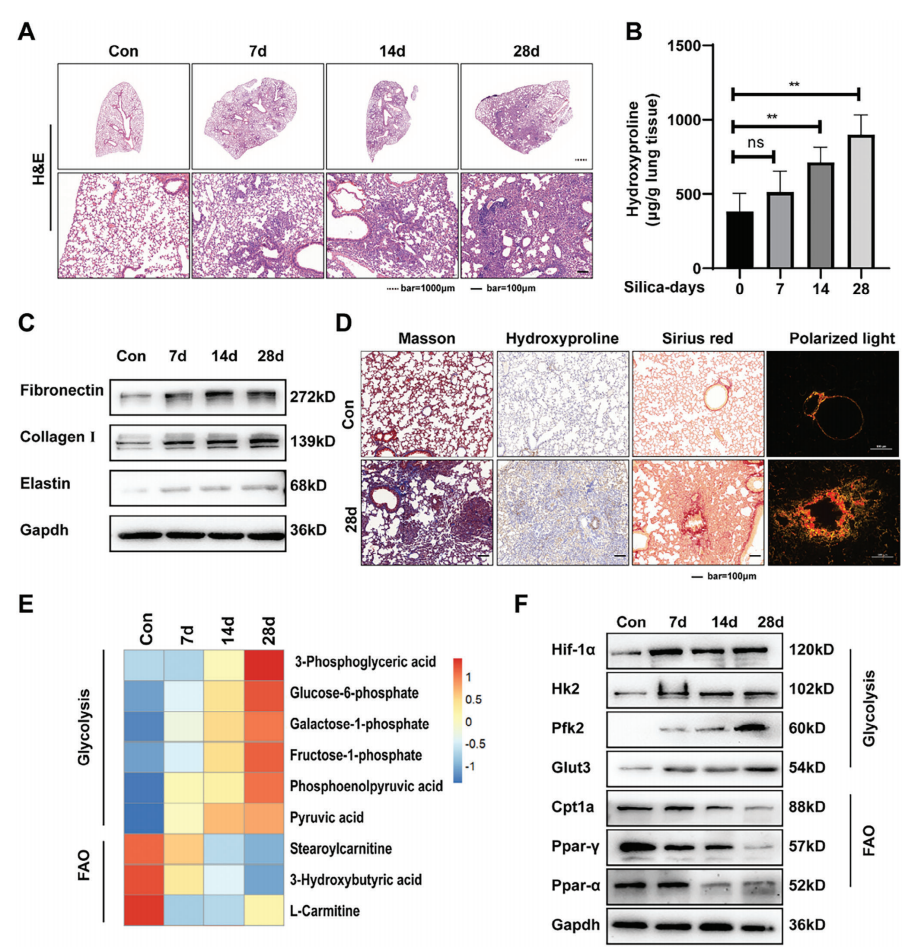
图1 小鼠肺纤维化的发展伴随着细胞代谢的重组
2、活化的成纤维细胞通过糖酵解和FAO的代谢扰动实现ECM的沉积
为探究成纤维细胞活化与代谢转变的关联,通过转化生长因子-β1(TGF-β1)诱导建立MRC-5成纤维细胞活化模型。结果显示,随TGF-β1浓度增加,α-平滑肌肌动蛋白(α-SMA)和I型胶原mRNA水平显著升高(图2A)。Western blot和免疫荧光分析表明,活化细胞中纤维连接蛋白、胶原蛋白I、弹性蛋白等ECM 蛋白表达显著增加(图2B-C)。线粒体荧光探针(Mito-Tracker)标记显示,TGF-β1处理后线粒体信号强度显著减弱,提示线粒体功能受损(图2D)。同时,能量稳态核心调控因子AMP激活蛋白激酶(AMPK)的磷酸化水平(p-AMPK)显著下降(图2E),进一步表明代谢状态异常。
qRT-PCR和Western blot显示,活化成纤维细胞中糖酵解关键基因(HIF-1α、HK2、PFK2)及蛋白表达上调,而FAO相关基因(CPT1a、PPAR-γ)及蛋白水平下调,与硅肺小鼠肺组织中的代谢表型一致。细胞代谢功能检测(ECAR和OCR)证实,活化细胞糖酵解能力增强,FAO水平降低(图2H-I)。综上,肺纤维化发展与成纤维细胞中FAO下调、糖酵解上调的代谢扰动密切相关。
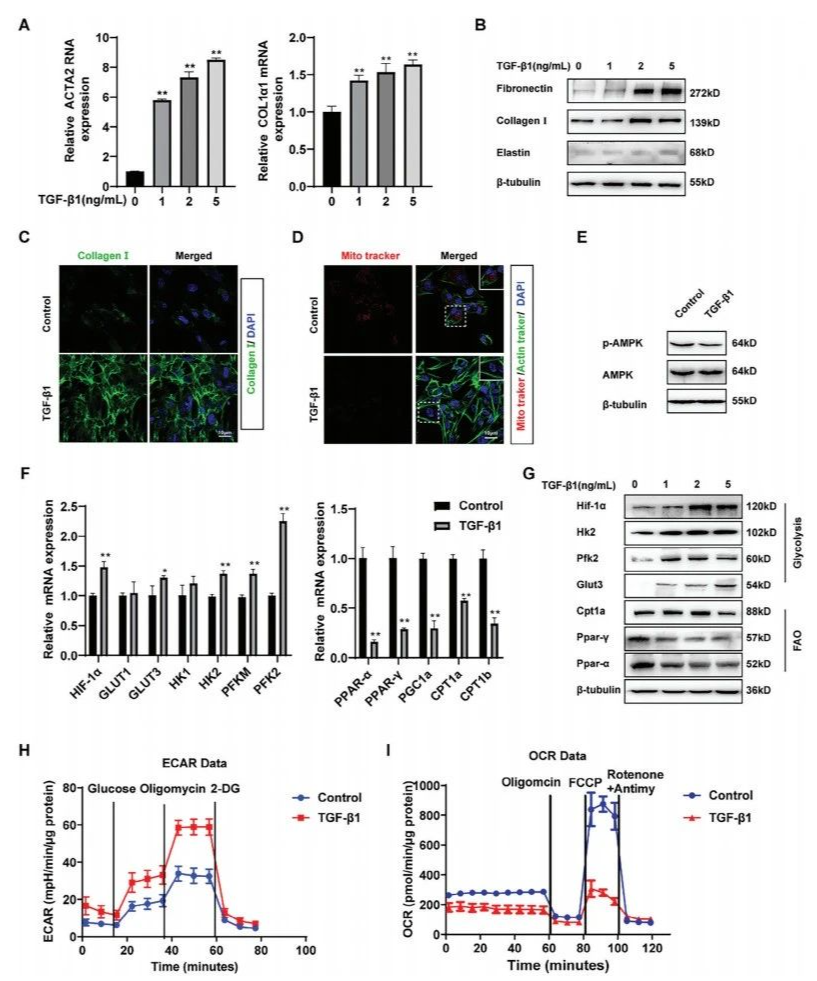
图2 活化成纤维细胞的ECM沉积是通过糖酵解和FAO的代谢扰动完成的
3、抑制糖酵解或增强FAO会影响活化成纤维细胞中的ECM沉积
为探究代谢干预对ECM沉积的影响,使用糖酵解抑制剂3PO或FAO激活剂吡格列酮处理TGF-β1活化的成纤维细胞。结果显示,两种干预均能显著减少ECM蛋白(纤维连接蛋白、胶原I、弹性蛋白)的表达(图3A)。免疫荧光染色表明,3PO处理导致细胞外胶原I荧光信号减弱,而吡格列酮处理则使细胞内胶原I信号降低(图3B),提示两者通过不同机制影响胶原分布。进一步分析显示,抑制糖酵解可减少不溶性ECM,同时增加培养基中可溶性胶原含量(图3C-D),伴随赖氨酸氧化酶(LOX)活性降低和甘氨酸合成减少(图3E-F);而增强FAO对ECM溶解度无显著影响,但可促进溶酶体与胶原的共定位(图3G),并增强外源性DQ-胶原的内吞降解(图3H)。综上,抑制糖酵解通过削弱ECM合成与修饰发挥作用,增强FAO则通过促进细胞内降解途径抑制ECM沉积,两者均能有效抑制纤维化相关ECM积累。

图3 抑制糖酵解或增强FAO影响活化成纤维细胞中ECM沉积
4、抑制糖酵解和增强脂肪酸氧化在体内的干预和治疗效果
为验证代谢干预的体内疗效,构建二氧化硅诱导的肺纤维化小鼠模型,分别在暴露后立即(干预组)或纤维化形成后(治疗组)给予糖酵解抑制剂3PO或FAO激活剂吡格列酮。干预结果(图4A-B)显示,暴露后立即给药可显著减轻肺泡结构破坏和肺纤维化程度,Masson染色和天狼星红染色显示Ⅰ型胶原、纤维连接蛋白等ECM沉积显著减少。然而,3PO干预组肺组织仍存在羟脯氨酸阳性染色(图4B),提示残留胶原降解不完全;吡格列酮干预组则通过CHP染色显示细胞内胶原降解信号增强(图4D),表明其促进ECM内吞降解的作用。
治疗效果(图5A-B)显示,对已形成的纤维化(造模28天后给药),吡格列酮仅部分缓解胶原沉积,而3PO可减轻肺损伤但仍有胶原碎片残留。Western blot证实,两种干预均能下调纤维连接蛋白、胶原I、弹性蛋白的表达(图5C)。CHP染色(图5D)进一步显示,3PO治疗组肺组织中CHP荧光强度较低,提示变性胶原减少;而吡格列酮组CHP信号较强且集中于细胞核周围,表明其促进胶原内吞降解的作用。然而,羟脯氨酸染色与CHP结果不完全一致,可能因前者检测完整胶原,后者特异性结合变性胶原,提示两种药物对ECM的作用路径不同:3PO主要抑制胶原合成,吡格列酮则通过增强FAO促进胶原的细胞内降解。

图4 抑制糖酵解或增强FAO可以阻止体内纤维化的进展
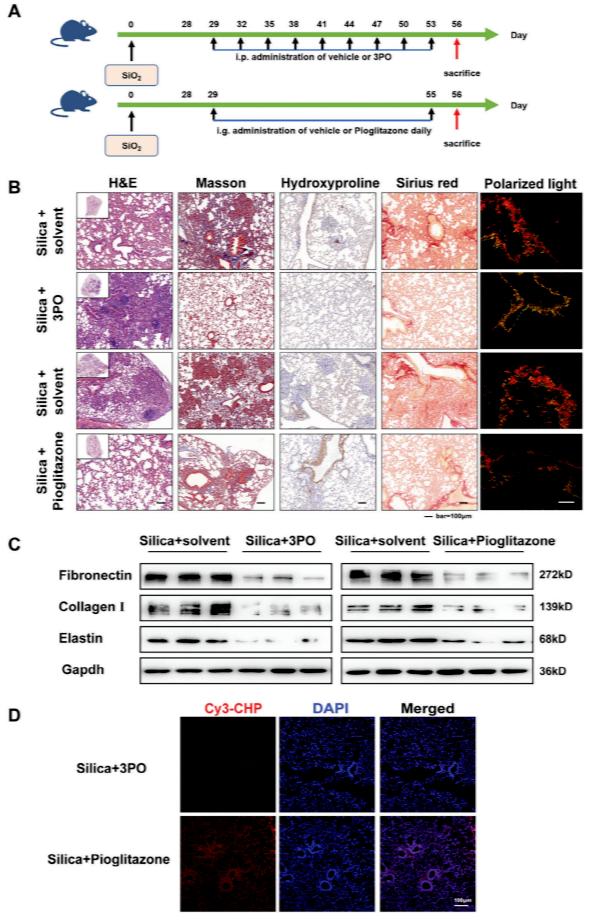
图5 3PO或吡格列酮给药可在体内缓解已建立的肺纤维化
5、HIF-1α调节成纤维细胞中脂肪酸氧化-糖酵解的转化
为解析单一代谢干预的复杂效应,研究发现:3PO抑制糖酵解可显著增加耗氧率(Oxygen Consumption Rates, OCR),提示FAO代偿性激活;而吡格列酮增强FAO仅轻度减少细胞外酸化率(Extracellular Acidification Rates, ECAR),糖酵解未显著受抑。这表明,单独干预糖酵解或FAO会引发难以预测的代谢补偿,因此筛选调控双代谢途径的核心因子尤为重要。
转录组分析显示,HIF-1α在纤维化肺组织中显著上调。进一步实验(图6B-C)显示,在TGF-β1诱导的成纤维细胞活化模型中,HIF-1α mRNA和蛋白水平均呈时间依赖性升高:刺激24小时后,HIF-1α mRNA表达增加2.3倍(图6B),蛋白水平在48小时达到峰值(图6C),且其降解被环己酰亚胺(CHX)抑制,提示TGF-β1通过延长蛋白半衰期增强HIF-1α稳定性。免疫组化证实,特发性肺纤维化(IPF)和硅肺患者的纤维化区域中,HIF-1α表达上调,而FAO关键转录因子PPAR-γ表达下调,且两者在小鼠硅肺模型中呈现一致趋势(图6A)。
机制研究表明,TGF-β1通过抑制HIF-1α泛素化,在常氧条件下稳定其蛋白水平。进一步功能实验显示,敲低HIF-1α可逆转TGF-β1诱导的糖酵解增强(ECAR降低)和FAO减弱(OCR恢复),并恢复线粒体数量及AMPK活性(图6D-H),证实HIF-1α是调控FAO-糖酵解代谢切换的核心分子。
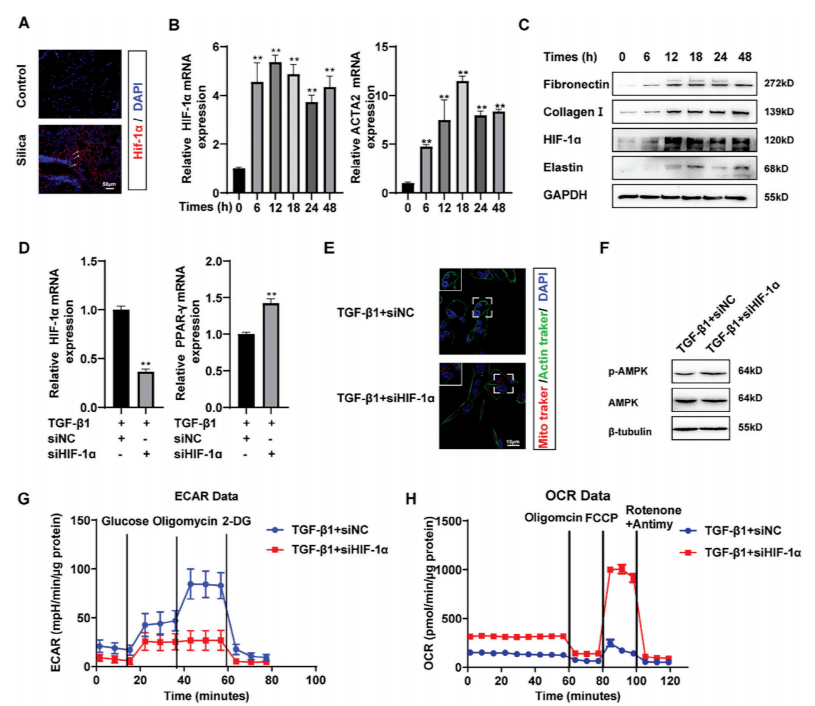
图6 HIF-1α调控成纤维细胞FAO糖酵解的转化
6、HIF-1α抑制通过调节糖酵解-FAO代谢紊乱减少ECM沉积
为探究抑制HIF-1α能否通过调控糖酵解-FAO代谢失衡增强ECM清除,在MRC-5细胞中敲低HIF-1α,结果显示ECM相关蛋白(如纤维连接蛋白、胶原I)表达显著降低(图7A)。免疫荧光证实,胞内及胞外胶原I荧光强度均显著减弱(图7C),表明HIF-1α抑制可有效减少体外TGF-β1诱导的ECM沉积。
机制研究发现,敲低HIF-1α后,胶原编码基因(如 COL1A1)转录水平未显著改变(图7B),但ECM修饰酶(LOX、LOXL2、P4AH1、PLOD1、PLOD2)的mRNA 水平显著下调(图7D),伴随LOX酶活性降低和可溶性胶原增加(图7F)。此外,成纤维细胞对DQ-胶原的内吞效率及溶酶体共定位显著增强(图7G-I),提示ECM交联减少且降解途径激活。
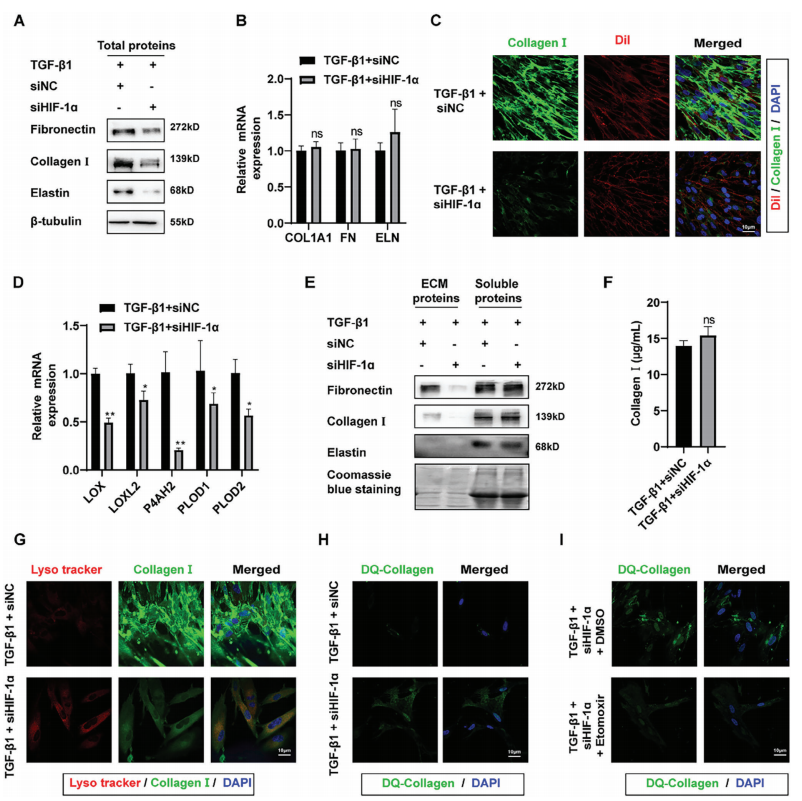
图7 HIF-1α抑制通过调节糖酵解-FAO代谢紊乱减少ECM沉积
7、抑制HIF-1α调节的脂肪酸氧化-糖酵解代谢扰动在体内减轻肺纤维化
为验证HIF-1α抑制的体内治疗效果,在二氧化硅粉尘滴注后的第二天或已形成纤维化的小鼠(造模28天后),分别用两种代谢调节剂(3PO联合吡格列酮)或一种HIF-1α抑制剂(LW6)处理小鼠,以评估干预或治疗效果(图8A和图9A)。
对小鼠肺组织进行的H&E染色显示,LW6组和3PO联合吡格列酮组小鼠的肺部纤维化程度有所减轻。此外,Masson染色和羟脯氨酸免疫组化结果表明,小鼠肺组织中的胶原沉积相对减少。同时,天狼星红染色显示胶原沉积减少,偏振光显微镜观察发现,LW6组和3PO联合吡格列酮组中复杂且紧密堆积的胶原减少(图8B和图9B)。Western blot结果显示,LW6组和3PO联合吡格列酮组中纤连蛋白、I型胶原和弹性蛋白的表达下调(图8C和图9C)。与此一致的是,研究者发现纤维化病变的严重程度和位置有了明显改善(图8D和图9D)。这些结果表明,在体内抑制HIF-1α调控的代谢转变能够有效减少暴露于二氧化硅粉尘的小鼠肺部ECM的过度沉积。
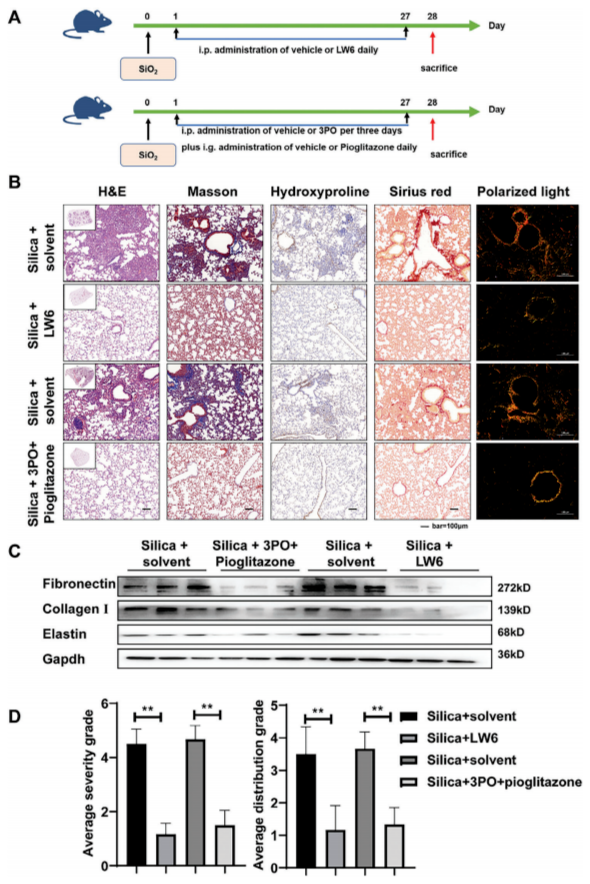
图8 抑制HIF-1β或FAO-糖酵解代谢扰动可阻止体内纤维化的进展
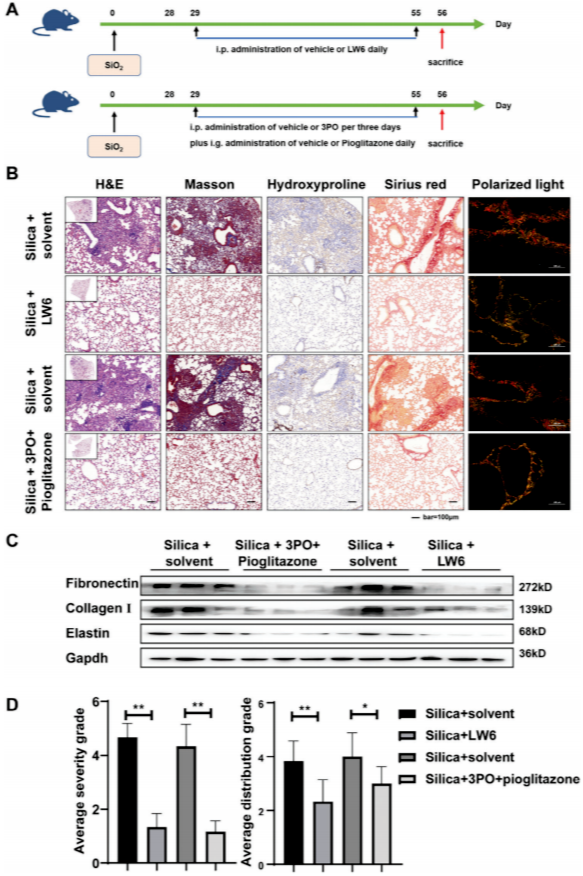
图9 抑制HIF-1α或改善FAO-糖酵解代谢扰动促进体内已建立的纤维化消退
3
研究结论
本研究发现,在二氧化硅诱导的肺纤维化中,糖酵解增强和FAO减少,促使细胞外基质合成与降解失衡,推动疾病发展。HIF-1α在调节FAO-糖酵解代谢转换、影响ECM重塑方面至关重要。因此,代谢疗法或靶向HIF-1α有望成为清除纤维化ECM、改善肺功能的有效策略。
END
杨炎 撰文
Peng 校稿
